Victor Ambros și Gary Ruvkun, laureații Premiului Nobel pentru Fiziologie sau Medicină 2024 (VIDEO)
Cei doi cercetători americani au descoperit microARN, explicând astfel „principiul fundamental care guvernează modul în care este reglată activitatea genelor”, a transmis Academia Regală Suedeză de Științe, cea care decernează Premiile Nobel.
 Premiul Nobel pentru Fiziologie sau Medicină 2024 a fost acordat cercetătorilor Victor Ambros, de la Universitatea din Massachusetts, și lui Gary Ruvkun, de la Harvard Medical School și Massachusetts General Hospital, pentru „descoperirea unui principiu fundamental care guvernează reglarea activității genelor”, a anunțat luni, Thomas Perlmann, profesor de Biologie moleculară la Institutul Karolinska din Stockholm, Suedia, care decernează aceste premii și Secretar general al Comitetului Nobel.
Premiul Nobel pentru Fiziologie sau Medicină 2024 a fost acordat cercetătorilor Victor Ambros, de la Universitatea din Massachusetts, și lui Gary Ruvkun, de la Harvard Medical School și Massachusetts General Hospital, pentru „descoperirea unui principiu fundamental care guvernează reglarea activității genelor”, a anunțat luni, Thomas Perlmann, profesor de Biologie moleculară la Institutul Karolinska din Stockholm, Suedia, care decernează aceste premii și Secretar general al Comitetului Nobel.
Interesați de modul în care se dezvoltă diferite tipuri de celule, cei doi oameni de știință au descoperit microARN – o nouă clasă de molecule ARN foarte mici, care joacă un rol crucial în reglarea genelor.
„Descoperirea lor revoluționară a dezvăluit un principiu complet nou de reglare a genelor, care s-a dovedit a fi esențial pentru organismele multicelulare, inclusiv pentru oameni”, a spus Perlmann.
 Victor Ambros și Gary Ruvukun au descoperit că microARN-urile au „o importanță fundamentală pentru modul în care organismele se dezvoltă și funcționează” genele. În contextul în care se știe că genomul uman codifică peste o mie de microARN-uri, descoperirea lor a ajutat la explicarea modului în care celulele pot produce proteine diferite, cu caracteristici diferite, în ciuda faptului că toate celulele noastre poartă același ADN.
Victor Ambros și Gary Ruvukun au descoperit că microARN-urile au „o importanță fundamentală pentru modul în care organismele se dezvoltă și funcționează” genele. În contextul în care se știe că genomul uman codifică peste o mie de microARN-uri, descoperirea lor a ajutat la explicarea modului în care celulele pot produce proteine diferite, cu caracteristici diferite, în ciuda faptului că toate celulele noastre poartă același ADN.
„Informațiile stocate în cromozomii noștri pot fi asemănate cu un manual de instrucțiuni pentru toate celulele din corpul nostru. Fiecare celulă conține aceiași cromozomi, deci conține exact același set de gene și exact același set de instrucțiuni. Cu toate acestea, diferite tipuri de celule, cum ar fi celulele musculare și nervoase, au caracteristici foarte distincte. Cum apar aceste diferențe? Răspunsul constă în reglarea genelor, care permite fiecărei celule să selecteze doar instrucțiunile relevante. Acest lucru asigură că numai setul corect de gene este activ în fiecare tip de celulă”, precizează Comitetului Nobel pentru Fiziologie sau Medicină.
 Premiul Nobel din acest an se concentrează pe „descoperirea seminală a microARN, care a introdus un mecanism nou și neașteptat de reglare a genelor. MicroARN-urile sunt importante pentru înțelegerea dezvoltării embriologiei, a fiziologiei celulare normale și a unor boli precum cancerul”, a explicat Olle Kämpe, vicepreședinte al Comitetului Nobel.
Premiul Nobel din acest an se concentrează pe „descoperirea seminală a microARN, care a introdus un mecanism nou și neașteptat de reglare a genelor. MicroARN-urile sunt importante pentru înțelegerea dezvoltării embriologiei, a fiziologiei celulare normale și a unor boli precum cancerul”, a explicat Olle Kämpe, vicepreședinte al Comitetului Nobel.
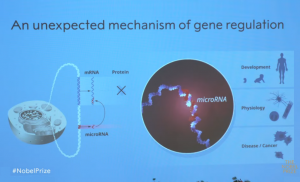
În interiorul nucleului celulelor noastre, informațiile genetice sunt stocate ca moleculă ADN dublu catenară. Pentru a crea proteine (molecule care îndeplinesc o serie de funcții în celule), o secțiune de ADN sau genă este copiată pentru a produce o moleculă monocatenar numită ARNmesager (ARNm), care acționează ca un „intermediar”, transportând instrucțiunile către „mașinile” de producere a proteinelor din celule. Acolo, ARNm-urile sunt traduse astfel încât proteinele să fie făcute conform instrucțiunilor genetice stocate în ADN. „Întrebarea este: ce face ca numai genele potrivite să fie transcrise în ARNm și apoi traduse în proteinele corecte specifice țesutului la momentul potrivit? Timp de mulți ani, oamenii de știință au crezut că au răspunsul în proteine, numite factori de transcripție. Acestea se leagă de ADN și fie activează, fie împiedică producerea de ARNm”, a adăugat Kämpe.
 Povestea care a determinat Adunarea Nobel de la Institutul Karolinska să acorde anul acesta Premiul Nobel pentru Fiziologie sau Medicină este însă mult mai veche.
Povestea care a determinat Adunarea Nobel de la Institutul Karolinska să acorde anul acesta Premiul Nobel pentru Fiziologie sau Medicină este însă mult mai veche.
„În anii 1960, s-a demonstrat că proteinele specializate, cunoscute sub numele de factori de transcripție, se pot lega de regiuni specifice din ADN și pot controla fluxul de informații genetice prin determinarea ARNm-urilor produse. De atunci, au fost identificați mii de factori de transcripție și multă vreme s-a crezut că principiile principale ale reglării genelor au fost rezolvate. Cu toate acestea, în 1993, laureații Nobel din acest an au publicat descoperiri neașteptate care descriu un nou nivel de reglare a genelor, care s-a dovedit a fi semnificativ și conservat de-a lungul evoluției”, potrivit Karolinska Instituted.
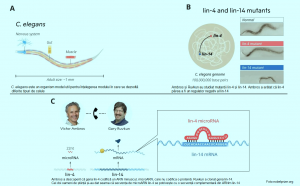
La sfârșitul anilor 1980, Ambros și Ruvkun au fost bursieri postdoctorali în laboratorul lui Robert Horvitz , care a primit Premiul Nobel în 2002, alături de Sydney Brenner și John Sulston. Ei au studiat, aici, un vierme rotund de 1 mm lungime relativ modest, C. elegans și au arătat că întinderi mici de ARN, cunoscute sub numele de microARN, s-ar putea lega direct de ARNm, împiedicând instrucțiunile pentru proteina corespunzătoare să fie „citite” de „mașinile” de producere a proteinelor. Descoperirile lor, publicate în revista Cell, au fost primite inițial cu o tăcere aproape asurzitoare din partea comunității științifice.
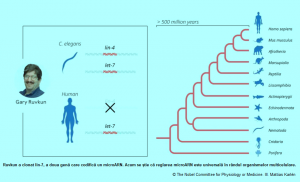 Percepția comunității științifice s-a schimbat însă în 2000, când grupul de cercetare al lui Ruvkun a publicat descoperirea unui alt microARN, lin-7, foarte conservată și prezentă în tot regnul animal.
Percepția comunității științifice s-a schimbat însă în 2000, când grupul de cercetare al lui Ruvkun a publicat descoperirea unui alt microARN, lin-7, foarte conservată și prezentă în tot regnul animal.
În următorii ani au fost identificate sute de microARN-uri diferite, iar astăzi, știm că există mai mult de o mie de gene pentru diferite microARN la oameni, iar reglarea genelor de către microARN este universală în rândul organismelor multicelulare. Pe lângă cartografierea noilor microARN, experimentele efectuate de mai multe grupuri de cercetare au elucidat mecanismele modului în care microARN-urile sunt produse și livrate la secvențe țintă complementare în mRNA. Legarea microARN duce la inhibarea sintezei proteinelor sau la degradarea ARNm. Un singur microARN poate regla expresia multor gene diferite, în timp ce o singură genă poate fi reglată de mai multe microARN-uri, coordonând și ajustand astfel rețele întregi de gene.
 Reglarea genelor prin microARN, dezvăluită pentru prima dată de Ambros și Ruvkun, funcționează însă de sute de milioane de ani. Acest mecanism a permis evoluția unor organisme din ce în ce mai complexe. Știm din cercetările genetice că celulele și țesuturile nu se dezvoltă normal fără microARN. Reglarea anormală de către microARN poate contribui la apariția cancerului, iar mutații ale genelor care codifică microARN au fost găsite la oameni, provocând afecțiuni precum pierderea congenitală a auzului, tulburări ale ochilor și ale scheletului. Mutațiile uneia dintre proteinele necesare producției de microARN au ca rezultat sindromul DICER1, un sindrom rar, dar sever, legat de cancerul în diferite organe și țesuturi.
Reglarea genelor prin microARN, dezvăluită pentru prima dată de Ambros și Ruvkun, funcționează însă de sute de milioane de ani. Acest mecanism a permis evoluția unor organisme din ce în ce mai complexe. Știm din cercetările genetice că celulele și țesuturile nu se dezvoltă normal fără microARN. Reglarea anormală de către microARN poate contribui la apariția cancerului, iar mutații ale genelor care codifică microARN au fost găsite la oameni, provocând afecțiuni precum pierderea congenitală a auzului, tulburări ale ochilor și ale scheletului. Mutațiile uneia dintre proteinele necesare producției de microARN au ca rezultat sindromul DICER1, un sindrom rar, dar sever, legat de cancerul în diferite organe și țesuturi.
Descoperirea seminală a lui Ambros și Ruvkun în micul vierme C. elegans a fost neașteptată și a dezvăluit o nouă dimensiune a reglării genelor, esențială pentru toate formele complexe de viață.
 Victor Ambros s-a născut în 1953 în Hanover, New Hampshire, SUA. A obținut doctoratul î 1979, la Institutul de Tehnologie din Massachusetts (MIT), Cambridge, MA, unde a realizat și cercetări postdoctorale în perioada 1979-1985. Devine cercetător principal la Universitatea Harvard, Cambridge, MA, în 1985, iar în perioada 1992-2007 este profesor la Școala de Medicină Dartmouth. În prezent este profesor Silverman de Științe Naturale la Școala de Medicină a Universității din Massachusetts, Worcester, MA.
Victor Ambros s-a născut în 1953 în Hanover, New Hampshire, SUA. A obținut doctoratul î 1979, la Institutul de Tehnologie din Massachusetts (MIT), Cambridge, MA, unde a realizat și cercetări postdoctorale în perioada 1979-1985. Devine cercetător principal la Universitatea Harvard, Cambridge, MA, în 1985, iar în perioada 1992-2007 este profesor la Școala de Medicină Dartmouth. În prezent este profesor Silverman de Științe Naturale la Școala de Medicină a Universității din Massachusetts, Worcester, MA.
Gary Ruvkun s-a născut în Berkeley, California, SUA, în 1952. A obținut doctoratul la Universitatea Harvard în 1982. A fost bursier postdoctoral la Institutul de Tehnologie din Massachusetts (MIT), Cambridge, MA, între 1982-1985. În 1985, a devenit cercetător principal la Spitalul General din Massachusetts și la Școala Medicală Harvard, unde în prezent este profesor de genetică.
 Anunțați de Adunarea Nobel de la Institutul Karolinska, din Stockholm, Suedia, câștigătorii Premiului Nobel pentru Fiziologie sau Medicină vor împărți un premiu de 11 milioane de coroane suedeze (aprox. 810.000 lire sterline).
Anunțați de Adunarea Nobel de la Institutul Karolinska, din Stockholm, Suedia, câștigătorii Premiului Nobel pentru Fiziologie sau Medicină vor împărți un premiu de 11 milioane de coroane suedeze (aprox. 810.000 lire sterline).
Laureaţii Nobel pentru pentru Fiziologie sau Medicină în 2023 au fost Katalin Karikó şi Drew Weissman pentru descoperirile lor privind modificările bazelor nucleozidice care au permis dezvoltarea unor vaccinuri ARNm eficiente împotriva COVID-19.
Premiul a fost acordat de 114 ori, unui număr de 227 de laureaţi, între 1901 şi 2023.
Până în prezent, 13 femei au primit Premiul Nobel pentru Fiziologie sau Medicină.
În 1974, românul George Emil Palade devenea primul român laureat Nobel, fiind recompensat cu Premiul Nobel pentru Medicină sau Fiziologie, împreună cu Albert Claude şi Christian de Duve, pentru „descoperiri privind organizarea funcţională a celulei”, ce au avut un rol esenţial în dezvoltarea biologiei celulare moderne.
 Primul premiu Nobel pentru Medicină i-a fost acordat, în 1901, medicului german Emil Adolf von Behring, pentru cercetări asupra seroterapiei şi descoperirea serului antidifteric.
Primul premiu Nobel pentru Medicină i-a fost acordat, în 1901, medicului german Emil Adolf von Behring, pentru cercetări asupra seroterapiei şi descoperirea serului antidifteric.
Cel mai tânăr laureat a fost Frederick G. Banting, care în 1923, la 32 de ani, a primit premiul pentru descoperirea insulinei, alături de John James Rickard Macleod.
Cel mai vîrstnic laureat din istorie, Peyton Rous, avea 87 de ani și a fost premiat în 1966, pentru descoperirea virusurilor care induc tumori.
Sune Bergström şi Svante Pääbo, tată și fiu, au primit fiecare câte un premiu pentru medicină, la 40 de ani distanță unul de celălalt.
Ceremonia anunțării Premiilor Nobel 2021 a debutat luni, 7 octombrie, și va continua cu premiile pentru Fizică (marți), pentru Chimie (miercuri), pentru Literatură(joi), pentru Pace (vineri). Luni, 14 octombrie, vor fi anunţaţi laureaţii pentru Economie.
Premiile Nobel vor fi înmânate laureaţilor în cadrul unei ceremonii speciale, care va avea loc pe 10 decembrie, ziua morţii lui Alfred Nobel (1833-1896).















